lunes, 10 de septiembre de 2018
domingo, 2 de septiembre de 2018
semana 26
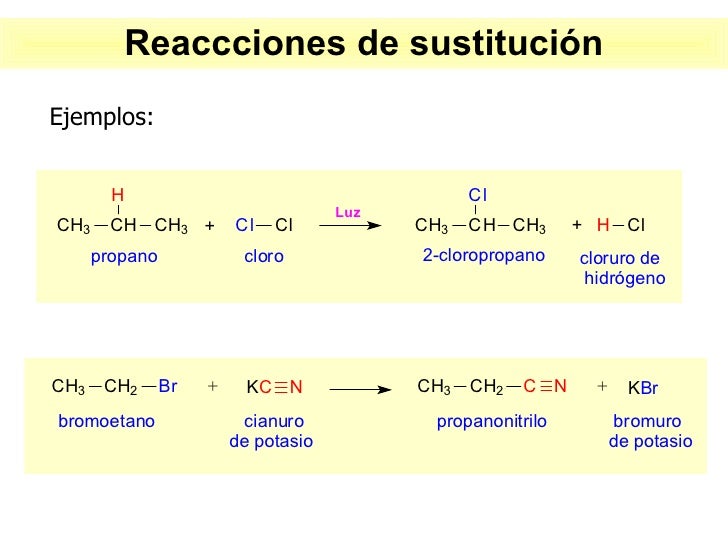
Reacciones químicas orgánicas:
En las reacciones orgánicas generalmente ocurren dos o mas etapas en las cuales se forman unas sustancias intermedias entre los negativos y el producto final.
Sustrato: es la sustancia que sera atacada por el reactivo y hace parte de el producto principal
Reactivo: en la Química orgánica generalmente hay 3 tipos de reactivos que son:
clasificación de reacciones orgánicas: se clasifican en polares y no polares
Polares:
No polares:

En las reacciones orgánicas generalmente ocurren dos o mas etapas en las cuales se forman unas sustancias intermedias entre los negativos y el producto final.
Sustrato: es la sustancia que sera atacada por el reactivo y hace parte de el producto principal
Reactivo: en la Química orgánica generalmente hay 3 tipos de reactivos que son:
- electrofilos
- nucleofilos
clasificación de reacciones orgánicas: se clasifican en polares y no polares
Polares:
- reacciones de sustitución o desplazamiento
- reacción de adición
- reacciones de eliminación
- reacciones de reagrupacion
- reacciones de oxidación
- reacciones de ácido-base
No polares:
- reacciones de sustitución o desplazamiento
- reacciones de adición
- reacciones de eliminación
- reacciones de reagrupacion

semana 25
Reacciones orgánicas
son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones redox orgánicas. En síntesis orgánica, se usan reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La producción de muchos químicos hechos por el hombre, tales como drogas, plásticos, aditivos alimentarios, textiles, dependen de las reacciones orgánicas.
Laboratorio:
Tema: Reconocimientos de algunos grupos funcionales y propiedades fisicas de compuestos orgánicos
Logros:
son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones redox orgánicas. En síntesis orgánica, se usan reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La producción de muchos químicos hechos por el hombre, tales como drogas, plásticos, aditivos alimentarios, textiles, dependen de las reacciones orgánicas.
Laboratorio:
Tema: Reconocimientos de algunos grupos funcionales y propiedades fisicas de compuestos orgánicos
Logros:
- reconocer experimentalmente aldehídos y cetonas, accidos carboxilicos y obtener acetileno
- Reconocer las propiedades físicas de algunos compuestos orgánicos
semana 24
proyección de Fischer
Ideada por el químico alemán Hermann Emil Fischer en 1891, es una proyección bidimensional utilizada en química orgánica para representar la disposición espacial de moléculas en las que uno o más átomos de carbono están unidos a 4 sustituyentes diferentes.
Estos átomos pueden existir en dos configuraciones especialmente diferentes, que son imágenes especulares(simétricas respecto a un plano) entre sí, como lo son la mano derecha de la izquierda, y al igual que éstas no son superponibles en el espacio.
Estos átomos constituyen centros quirales o de isomería espacial. Cada centro quiral da lugar a dos moléculas isómeras especulares o enantiómeros. Una molécula con 2 centros quirales puede tener 4 estereoisómeros (22 esteroisómeros, 2 parejas de enantiómeros); una con 3 centros quirales puede tener 8 estereoisómeros (23 esteroisómeros, 4 parejas de enantiómeros); y así sucesivamente.
Los estereoisómeros que posibilitan los centros quirales de una molécula son, en principio, iguales química y físicamente, salvo que al incidir sobre sus respectivas disoluciones la luz polarizada el plano de vibración de ésta gira un ángulo diferente en cada caso.
En una proyección de Fischer se representa cada carbono quiral con sus cuatro sustituyentes dispuestos en cruz aplicando la siguiente convención:
- Los sustituyentes situados a derecha e izquierda sobresalen del plano de representación (papel o pantalla) y en el espacio estarían situados por delante de dicho plano, hacia el observador.
- Los sustituyentes representados arriba y debajo del centro quiral estarían situados espacial mente detrás del átomo quiral.
Hay que cuidar de no girar 90º la proyección de una molécula dada, porque obtendremos la representación de su enantiómero: los sustituyentes que en la primera estaban dirigidos "hacia el fondo" habrán pasado a estarlo "hacia adelante" y viceversa.


semana 23
La isomería cis-trans o isomería geométrica :
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono.  Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans. El isómero que tiene los hidrógenos al mismo lado se llama cis, y el que los tiene a lados opuestos trans.
Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans. El isómero que tiene los hidrógenos al mismo lado se llama cis, y el que los tiene a lados opuestos trans.
Los compuestos cíclicos, debido a su rigidez, también presentan isomería geométrica. Así, el 1,2-dimetilciclohexano puede existir en forma de dos isómeros. Se llama isómero cis el que tiene los hidrógenos al mismo lado y trans el que los tiene a lados opuestos.
- Ambos poseen la misma fórmula.
- Tienen diferentes propiedades químicas y físicas
Conformaciones del butano:

semana 22
Isomeria conformacional:

Este tipo de isómeros conformacionales o confórmeros, la conversión de una forma en otra es posible pues la rotación en torno al eje del enlace formado por los átomos de carbono es más o menos libre (ver animación a la derecha). Por eso también reciben el nombre de rotameros.
Los isómeros conformacionales generalmente no son separables o aislables, debido a la facilidad de interconversión aún a temperaturas relativamente bajas. La rama de la estereoquímica que estudia los isómeros conformacionales que sí son aislables (la mayoría son derivados del bifenilo) se llama atropisomeria.

se realizo quiz de isomeria
semana 21
Isomeria estructural:
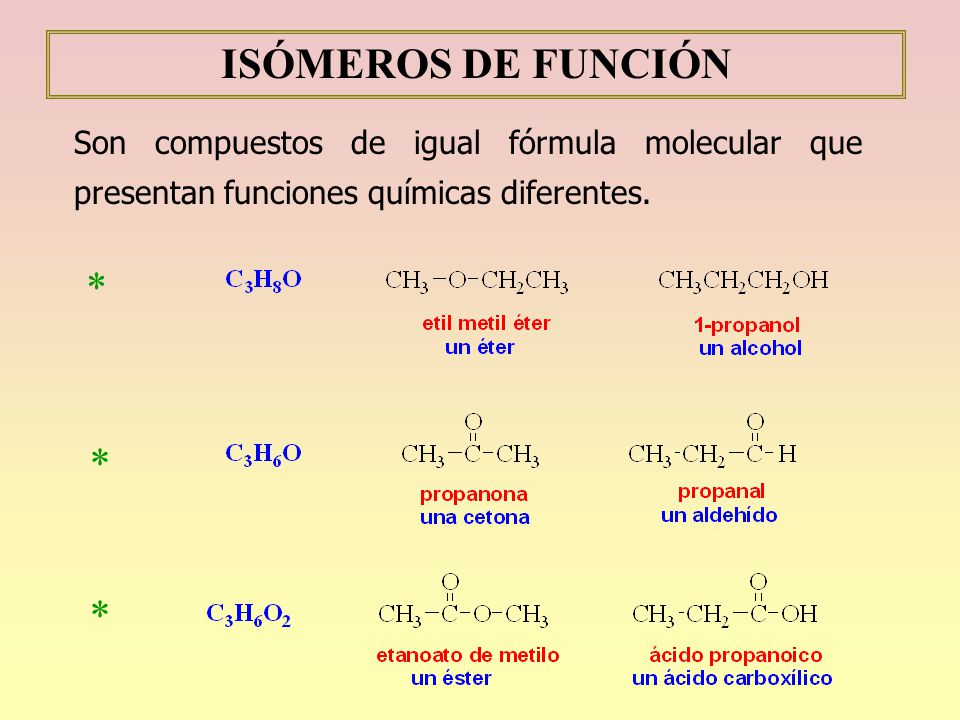
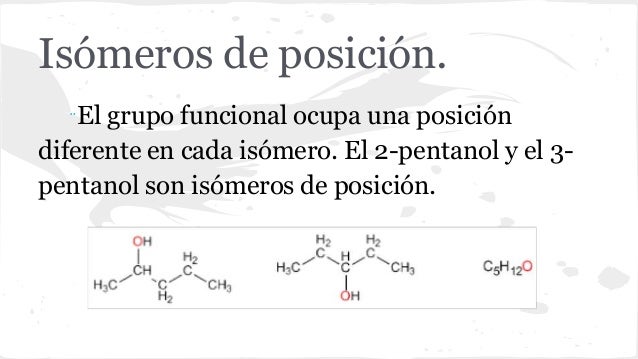
es una forma de isomeria en la que las moléculas con la misma fórmula molecular tienen diferentes patrones de unión y organización atómica, en oposición a estereoisomerismo , en el que los enlaces moleculares están siempre en el mismo orden y solo el arreglo espacial difiere. Hay sinónimos múltiples para isómeros constitucionales.
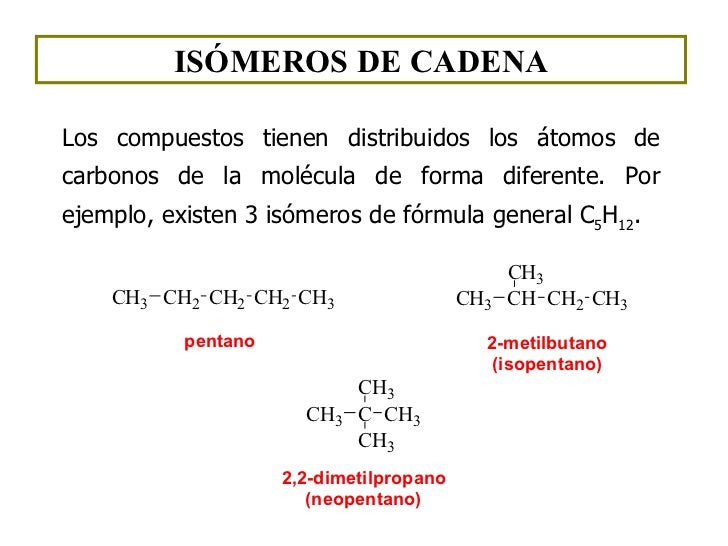
Isomeria de cadena:
Se llaman isómeros a aquellas moléculas que poseen la misma fórmula molecular pero diferente estructura. Se clasifican en isómeros estructurales y estéreo isómeros. Los isómeros estructurales difieren en la forma de unir los átomos y a su vez se clasifican en isómeros de cadena de posición y de función.



Isomeria espacial:
Presentan estéreo isomería aquellos compuestos que tienen fórmulas moleculares idénticas y sus átomos presentan la misma distribución (la misma forma de la cadena; los mismos grupos funcionales y sustituyentes; situados en la misma posición), pero su disposición en el espacio es distinta.
Los isómeros tienen igual forma en el plano. Es necesario representarlos en el espacio para visualizar las diferencias. Puede ser de dos tipos: isomería conformacional e isomería configuracional, según que los isómeros se puedan convertir uno en otro por simple rotación de enlaces simples, o no.
semana 20

ISOMERIA:
compuestos organicos
- son muy abundantes
- la mayoría poseen enlaces covalentes
- la mayoría son solubles e insolubles en h2O
- son de origen vegetal o animal
- la mayoría son combustibles
compuestos inorgánicos:
- hay muy pocos
- la mayoría poseen enlaces tónicos
- la mayoría son solubles en H2O e insolubles en orgánicos
- la mayoría no son combustibles

martes, 29 de mayo de 2018
Semana 16
Taller de nomenclatura:
Estos son algunos de los ejercicios explicados en clase esta semana





Estos son algunos de los ejercicios explicados en clase esta semana





Semana 15
realización del taller del documento como practica para el taller en esta semana se vio la explicaron teórica de como resolver el taller.
grupos funcionales:

grupos funcionales:

Semana 14
se trabajo en la sala de informática y se recibió clase teórica sobre el benceno y nomenclatura de ciclos se repartieron los temas del proyecto de cada grupo de trabajo y se trabajo también la wiki para dicho proyecto
Grupo #06
Sonia contreras
Natalia aguirre
Any guzman
Susana garcía



Grupo #06
Sonia contreras
Natalia aguirre
Any guzman
Susana garcía


lunes, 28 de mayo de 2018
Semana 13
continuación de documento de nomenclatura
NOMBRE DE LA RAÍZ:
El nombre de la raíz se designa mediante un término que indica su número de átomos de carbono, aunque algunas veces y por eufonía se le adiciona la letra (a) ej. Hept --- Hepta.
RAÍCES INDICATIVAS DEL NÚMERO DE CARBONOS:
PREFIJOS:
Son todas las designaciones que aparecen antes de la raíz
PREFIJO PRIMARIO:Es un término antepuesto a la raíz y relacionado con su naturaleza; se emplean las palabras como ciclo (cadena cerrada) espirano, biciclo, etc. Pero si la cadena es abierta no se utiliza ningún término.
PREFIJOS SECUNDARIOS Son las funciones secundarias y las ramificaciones carbonadas.
FUNCIONES SECUNDARIAS
Es el conjunto restante de grupos funcionales de un compuesto, después de seleccionar la función principal, los cuales se designan mediante los términos descritos anteriormente.
Las funciones secundarias se nombran, conjuntamente con los radicales, en orden alfabético, especificando la posición que ocupa en la cadena principal, el número de veces que se repiten (multiplicidad: di, tri, tetra, etc.) y su nombre particular; al escribir lo anterior, las posiciones se especifican con los números (y algunas veces letras usadas como localizadores n, N etc.) separados por comas entre sí y por un guión de la letra siguiente; por ej. 2,3 – dihidroxi; N, N dimetil amina etc.
RADICALES O RAMIFICACIONES: Un radical o ramificación es cada conjunto carbonado que no es grupo funcional, situado por fuera de la secuencia principal y como ya se anotó, se lee conjuntamente con las funciones secundarias en orden alfabético, especificando su posición (es) multiplicidad y nombre, pero es necesario anotar que para radicales sencillos el orden alfabético no es afectado por la multiplicidad
NOMBRE DE LA RAÍZ:
El nombre de la raíz se designa mediante un término que indica su número de átomos de carbono, aunque algunas veces y por eufonía se le adiciona la letra (a) ej. Hept --- Hepta.
RAÍCES INDICATIVAS DEL NÚMERO DE CARBONOS:
# C
|
RAIZ
|
# C
|
RAIZ
|
# C
|
RAÍZ
|
# C
|
RAÍZ
|
# C
|
RAIZ
|
1
2
3
4
5
|
met
et
prop
but
pent
|
6
7
8
9
10
|
hex
hept
oct
non
dec
|
11
12
13
14
15
|
Undec
Dodec
Tridec
Tretadec
pentadec
|
20
21
30
31
40
|
Eicos
Uneicos
Triacont
Unetriacont
tetracont
|
50
60
70
80
100
200
|
Penta cont
Hexa cont
Hepta cont
Octa cont
Hect
dihect
|
PREFIJOS:
Son todas las designaciones que aparecen antes de la raíz
PREFIJO PRIMARIO:Es un término antepuesto a la raíz y relacionado con su naturaleza; se emplean las palabras como ciclo (cadena cerrada) espirano, biciclo, etc. Pero si la cadena es abierta no se utiliza ningún término.
FUNCIONES SECUNDARIAS
Es el conjunto restante de grupos funcionales de un compuesto, después de seleccionar la función principal, los cuales se designan mediante los términos descritos anteriormente.
Las funciones secundarias se nombran, conjuntamente con los radicales, en orden alfabético, especificando la posición que ocupa en la cadena principal, el número de veces que se repiten (multiplicidad: di, tri, tetra, etc.) y su nombre particular; al escribir lo anterior, las posiciones se especifican con los números (y algunas veces letras usadas como localizadores n, N etc.) separados por comas entre sí y por un guión de la letra siguiente; por ej. 2,3 – dihidroxi; N, N dimetil amina etc.
RADICALES O RAMIFICACIONES: Un radical o ramificación es cada conjunto carbonado que no es grupo funcional, situado por fuera de la secuencia principal y como ya se anotó, se lee conjuntamente con las funciones secundarias en orden alfabético, especificando su posición (es) multiplicidad y nombre, pero es necesario anotar que para radicales sencillos el orden alfabético no es afectado por la multiplicidad
Semana 12
TEMA: NOMENCLATURA
OBJETIVO: Aplicar las normas de la nomenclatura según la IUPAC para nombrar compuestos orgánicos.
EVALUACIÓN: Se deben aplicar las normas de la nomenclatura para resolver el taller propuesto al final del documento.
INTRODUCCIÓN
La comunicación sobre cualquier tema depende de un idioma; para la Química se ha desarrollado un lenguaje especial (nomenclatura) que es necesario conocer par facilitar la comunicación entre las personas relacionadas con esta área del saber.
La nomenclatura debe ser funcional y precisa, de tal manera que cada compuesto orgánico sea identificable mediante un solo nombre, el cual a la vez se relaciona con su estructura. Aunque existen mas compuestos orgánicos (de los que nos interesa estudiar) algunos poseen mas de un nombre aceptado y utilizado, pues existe una tendencia generalizada entre los químicos: dar a los compuestos nombres comunes, no relacionados con sus estructuras específicas, sino con su origen, fuente de obtención, método de preparación, sitio de su descubrimiento etc. ; por ej. El ácido fórmico, ácido acético, acetaldehído, ácido oleico, etc. ; sin embargo, cuando el químico necesita reportar algo acerca de un compuesto orgánico debe utilizar en sus publicaciones su nombre sistemático para facilitar la identificación de la estructura por parte del lector; es por ello que se hace énfasis en los nombres sistemáticos, que se ajustan a las reglas de nomenclatura aceptadas internacionalmente, las cuales han evolucionado por cerca de cien años, son el resultado del estudio cuidadoso y el acuerdo previo entre los miembros de una organización de químicos denominada I.U.P.A.C (unión internacional de Química pura y aplicada).
CONCEPTOS GENERALES
La estructura de los compuestos orgánicos está constituida por una ó más cadenas carbonadas y grupos funcionales; una de las cadenas carbonadas es la principal y las demás son las cadenas secundarias que se llaman radicales o ramificaciones; de manera similar, dentro de los grupos funcionales, uno es el principal y los demás se conocen como
funciones secundarias:
El nombre sistemático de un compuesto orgánico consta de tres partes: prefijos- raíz – Sufijos; cada una de ellas relacionada estrechamente con la estructura. La raíz es la unidad básica del nombre, se relaciona con la cadena principal del compuesto y es esencial en todo nombre.
Los prefijos son accidentales, pueden ser o no parte constitutiva del nombre de un compuesto dependiendo de la estructura.
Los accidentes estructurales se designa mediante prefijos primarios y/o secundarios, el secundario comprende los radicales y las funciones secundarias y el primero se refiere a la naturaleza de la raíz o secuencia carbonada principal (cíclica, bicíclica, espiránica); por último, se tienen los sufijos, que son también esenciales en el nombre, los cuales se clasifican en primarios y secundarios; los sufijos primarios se relacionan con el tipo de enlace entre los átomos de carbono de la cadena principal y los sufijos secundarios con la función principal.
Resumiendo, todo el nombre sistemático está estructurado así:
- PREFIJO 2º PREFIJO 1º RAÍZ SUFIJO 1º SUFIJO 2º
- CADENA PRINCIPAL O RAÍZ
Es la secuencia carbonada progenitora del compuesto particular y equivale al hidrocarburo no ramificado del mismo número de átomos de carbono; dicha secuencia es común para todos los compuestos que resulten de sustituir uno ó más hidrógenos de ese hidrocarburo por átomos diferentes al carbono y que originan grupos funcionales.
Ejemplo: si el hidrocarburo progenitor es CH 3 CH 2 CH 3 , algunos de sus derivados son: CH 3 CH 2 CH 2 OH
CH 3 CH 2 CH 2 Cl CH 3 CH 2 CH 2 NH 2 (remplazando un H por los grupos funcionales, OH, Cl, NH 2 ) CH 3 CH 2 CHO (reemplazando 2H por O=)
SELECCIÓN:
La secuencia principal debe ser la cadena continua más extensa de átomos de carbono que cumpla el siguiente orden de
prioridades, incluyendo:
- a. El mayor número de veces la función principal.
- b. El mayor número de instauraciones con predomino del enlace doble sobre el triple.
- c. El mayor número de otros grupos funcionales y sustituyentes en general.
domingo, 11 de marzo de 2018
semana 7
se realiza el quiz de lo visto en clase
Alcanos:
Los alcanos son hidrocarburos,
es decir, compuestos que sólo contienen átomos de carbono e hidrógeno.
La fórmula general para alcanos alifáticos (de cadena lineal) es CnH2n+2, y para cicloalcanos es CnH2n. También reciben el nombre de hidrocarburos saturados, ya que carecen de enlaces dobles o triples y, por tanto, todos sus carbonos presentan hibridación sp3. Además, carecen de grupos funcionales.
Alquenos:
Los alquenos son hidrocarburos insaturados que tienen uno o varios enlaces carbono-carbono en su molécula. Se puede decir que un alqueno es
un alcano que ha perdido dos átomos de hidrógeno produciendo como
resultado un enlace doble entre dos carbonos. Los alquenos cíclicos
reciben el nombre de cicloalquen
Alquinos:
Los alquinos son hidrocarburos alifáticos con al menos un triple enlace (dos enlaces π pi y uno Σ sigma)
-C≡C- entre dos átomos de carbono. Se trata de
compuestos metaestables debido a la alta energía del triple enlace
carbono-carbono. Su fórmula general es CnH2n-2.
semana 6
Quimica organica
La Química
orgánica o Química del carbono es la rama de la química que estudia una
clase numerosa de moléculas, conocidos como compuestos orgánicos, que
contienen carbono formando enlaces covalentes carbono-carbono,
carbono-hidrógeno y otros heteroátomos.
teoría vitalista
la
cual suponía que los compuestos orgánicos jamás podían obtenerse de
manera artificial, ya que podían originarse únicamente en los organismos
vivos. 1675. Lémerg clasifica a los productos químicos naturales, según
sea su origen en: MINERALES, VEGETETALES Y ANIMALES.
hibridacion
En química, se conoce como hibridación a la interacción de orbitales atómicos dentro de un átomo para formar nuevos orbitales híbridos.
Los orbitales atómicos híbridos son los que se superponen en la
formación de los enlaces, dentro de la teoría del enlace de valencia, y
justifican la geometría molecular.
El
químico Linus Pauling desarrolló por primera vez la teoría de la
hibridación con el fin de explicar la estructura de las moléculas como
el metano (CH4) en 1931.1
Este concepto fue desarrollado para este tipo de sistemas químicos
sencillos, pero el enfoque fue más tarde aplicado más ampliamente, y hoy
se considera una heurística eficaz para la racionalización de las
estructuras de compuestos orgánicos.
hibridacion sp3
El
átomo de carbono tiene seis electrones: dos se ubican en el orbital 1s
(1s²), dos en el 2s (2s²) y los restantes dos en el orbital 2p (2p²).
Debido a su orientación en el plano tridimensional el subnivel 2p tiene
capacidad para ubicar 6 electrones: 2 en el orbital px, dos en el orbital py y dos electrones en el orbital pz. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón):
hibridacion sp2
Se
define como la combinación de un orbital s y dos orbitales p, para
formar 3 orbitales híbridos, que se disponen en un plano formando
ángulos de 120º.
Los átomos que forman hibridaciones sp2 pueden
formar compuestos con enlaces dobles. Forman un ángulo de 120º y su
molécula es de forma plana. A los enlaces simples se les conoce como
enlaces sigma (σ) y los enlaces dobles están compuestos por un enlace
sigma y un enlace pi ( ).
Las reglas de ubicación de los electrones en estos casos, como
el alqueno etileno obligan a una hibridación distinta llamada sp2,
en la cual un electrón del orbital 2s se mezcla sólo con dos de los
orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales
p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
).
Las reglas de ubicación de los electrones en estos casos, como
el alqueno etileno obligan a una hibridación distinta llamada sp2,
en la cual un electrón del orbital 2s se mezcla sólo con dos de los
orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales
p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
 ).
Las reglas de ubicación de los electrones en estos casos, como
el alqueno etileno obligan a una hibridación distinta llamada sp2,
en la cual un electrón del orbital 2s se mezcla sólo con dos de los
orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales
p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
).
Las reglas de ubicación de los electrones en estos casos, como
el alqueno etileno obligan a una hibridación distinta llamada sp2,
en la cual un electrón del orbital 2s se mezcla sólo con dos de los
orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales
p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
hibridacion sp
Se
define como la combinación de un orbital s y un orbital p, para formar 2
orbitales híbridos, con orientación lineal. Este es el tipo de enlace
híbrido, con un ángulo de 180º y que se encuentra existente en
compuestos con triples enlaces como los alquinos (por ejemplo
el acetileno):
Se caracteriza por la presencia de 2 orbitales pi (π).
El ciclo de el carbono
es el ciclo biogeoquímico por el cual el carbono se intercambia entre la biosfera, pedosfera, geosfera, hidrosfera y la atmósfera de la Tierra.


formas alotropicas de el carbono
diamante:
es
uno de los alótropos del carbono más conocidos, cuya dureza y
alta dispersión de la luz lo hacen útil para
aplicaciones industriales y joyería. El diamante es el mineral natural
más duro conocido, lo que lo convierte en un abrasivo excelente y le
permite mantener su pulido y lustre extremadamente bien. No se conocen
sustancias naturales que puedan rayar o cortar un diamante excepto un
diamante mismo.
grafito:
El grafito (denominado así por Abraham Gottlob Werner en 1789, del griego γράφειν (graphein,
"dibujar/escribir", por su uso en lápices) es uno de los alótropos más
comunes del carbono. A diferencia del diamante, el grafito es un
conductor eléctrico, y puede ser usado, por ejemplo, como material en
los electrodos de una lámpara de arco eléctrico. El grafito tiene la
distinción de ser la forma más estable de carbono a condiciones
estándar. En consecuencia, es usado en termoquímica como el estado
estándar para definir el calor de formación de los compuestos de
carbono.
fullereno :
es una molécula compuesta por carbono que puede adoptar una forma geométrica que recuerda a una esfera, un elipsoide, un tubo (llamado nanotubo) o un anillo. Los fullerenos son la tercera formamolecular estable conocida de carbono, tras el grafito y el diamante.
Suscribirse a:
Comentarios (Atom)