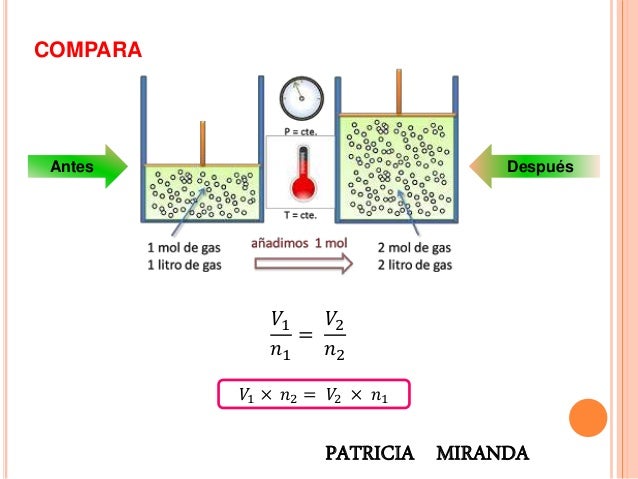
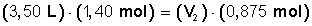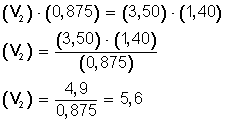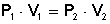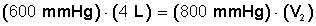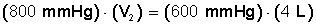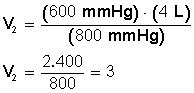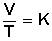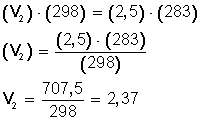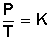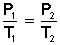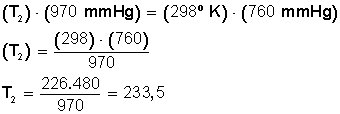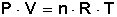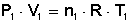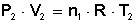que se traduce en que si dividimos el volumen de un gas por el número de moles que lo conforman obtendremos un valor constante.
Esto
se expresa en la ecuaciónEsto debido a que si ponemos más moles
(cantidad de moléculas) de un gas en un recipiente tendremos,
obviamente, más gas (más volumen), así de simple.
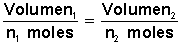 , simplificada es
, simplificada es 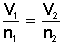
Veamos un ejemplo práctico y sencillo:
Tenemos
3,50 L de un gas que, sabemos, corresponde a 0,875 mol. Inyectamos gas
al recipiente hasta llegar a 1,40 mol, ¿cuál será el nuevo volumen del
gas? (la temperatura y la presión las mantenemos constantes).
Solución:
Aplicamos la ecuación de la ley de Avogadro:
y reemplazamos los valores correspondientes:
resolvemos la ecuación, multiplicando en forma cruzada:
Ahora, despejamos V 2 , para ello, pasamos completo a la izquierda el miembro con la incógnita (V 2 ), y hacemos:
Respuesta:
El nuevo volumen (V 2 ), ya que aumentamos los moles hasta 1,40 (n 2 ), es ahora 5,6 L
Ley de Boyle
Esta ley nos permite relacionar la presión y el volumen de un gas cuando la temperatura es constante.
La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando latemperatura es constante .
Lo cual significa que:
El volumen de un gas es inversamente proporcional a la presión que se le aplica:
En otras palabras:
Si la presión aumenta, el volumen disminuye.
Si la presión disminuye, el volumen aumenta.
Esto nos conduce a que, si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor .
Para aclarar este concepto:
Tenemos un cierto volumen de gas (V 1 ) que se encuentra a una presión P 1 . Si variamos la presión a P 2 , el volumen de gas variará hasta un nuevo valor V 2 , y se cumplirá:
que es otra manera de expresar la ley de Boyle.
Apliquemos la fórmula en un ejemplo práctico:
Tenemos
4 L de un gas que están a 600 mmHg de presión. ¿Cuál será su volumen si
aumentamos la presión hasta 800 mmHg? La temperatura es constante, no
varía.
Solución:
Como
los datos de presión están ambos en milímetros de mercurio (mmHg) no es
necesario hacer la conversión a atmósferas (atm). Si solo uno de ellos
estuviera en mmHg y el otro en atm, habría que dejar los dos en atm.
Aclarado esto, sustituimos los valores en la ecuación P 1 V 1 = P 2 V 2 .
Ponemos a la izquierda el miembro con la incógnita
Despejamos V 2 :
Respuesta:
Si aumentamos la presión hasta 800 mmHg el volumen disminuye hasta llegar a los 3 L.
Ley de Charles
Mediante esta ley relacionamos la temperatura y el volumen de un gas cuando mantenemos la presión constante.
Esta la ley afirma que:
El volumen de un gas es directamente proporcional a la temperatura del gas.
En otras palabras:
Si aumenta la temperatura aplicada al gas, el volumen del gas aumenta.
Si disminuye la temperatura aplicada al gas, el volumen del gas disminuye.
Matemáticamente
esto se expresa en la fórmulaComo lo descubrió Charles, si la cantidad
de gas y la presión permanecen constantes, el cociente entre el volumen
(V) y la temperatura (T) siempre tiene el mismo valor (K) (es
constante).
lo cual significa que el cociente entre el volumen y la temperatura es constante.
Intentemos ejemplificar:
tenemos un cierto volumen de gas V 1 que se encuentra a una temperatura T 1 . Si aumentamos la temperatura a T 2 el volumen del gas aumentará hasta V 2 , y se cumplirá que:
Esta es otra manera de expresar la ley de Charles.
- ejemplo práctico y sencillo:
Un
gas cuya temperatura llega a 25° C tiene un volumen de 2,5 L. Para
experimentar, bajamos la temperatura a 10° C ¿Cuál será su nuevo
volumen?
Solución:
El primer paso es recordar que en todas estas fórmulas referidas a la temperatura hay que usar siempre la escala Kelvin.
Por lo tanto, lo primero es expresar la temperatura en grados Kelvin:
T 1 = (25 + 273) K= 298 K
T 2 = (10 + 273 ) K= 283 K
Ahora, sustituimos los datos en la ecuación:
Ahora, despejamos V 2 :
Respuesta:
Si bajamos la temperatura hasta los 10º C (283º K) el nuevo volumen del gas será 2,37 L.
Ley de Gay-Lussac
Esta ley establece la relación entre la presión (P) y la temperatura (T) de un gas cuando el volumen (V) se mantiene constante, y dice textualmente:
La presión del gas es directamente proporcional a su temperatura.
Esto significa que:
Si aumentamos la temperatura, aumentará la presión.
Si disminuimos la temperatura, disminuirá la presión.

Si lo llevamos al plano matemático, esto queda demostrado con la siguiente ecuación:
la cual nos indica que el cociente entre la presión y la temperatura siempre tiene el mismo valor; es decir, es constante.
Llevemos esto a la práctica y supongamos que tenemos un gas, cuyo volumen (V) no varía, a una presión P 1 y a una temperatura T 1 . Para experimentar, variamos la temperatura hasta un nuevo valor T 2 , entonces la presión cambiará a P 2 , y tendrá que cumplirse la siguiente ecuación:
Esta es la misma Ley de Gay-Lussac expresada de otra forma.
Debemos
recordar, además, que esta ley, al igual que la de Charles, está
expresada en función de la temperatura absoluta, y tal como en la Ley de
Charles, las temperaturas han de expresarse en grados Kelvin.
Veamos un ejemplo:
Tenemos
un cierto volumen de un gas bajo una presión de 970 mmHg cuando su
temperatura es de 25° C. ¿A qué temperatura deberá estar para que su
presión sea 760 mmHg?
Solución:
Lo primero que debemos hacer es convertir los 25º C a grados Kelvin:
T 1 = (25 + 273) K= 298 K
Ahora sustituimos los datos en la ecuación:
Ahora despejamos T 2 :
Respuesta:
La temperatura debe bajar hasta los 233,5º Kelvin. Si convertimos estos grados en grados Celsius hacemos
233,5 − 273 = −39,5 °C.
Ley general de los gases o ecuación general de los gases
Las
leyes parciales analizada precedentemente pueden combinarse y obtener
una ley o ecuación que relaciones todas las variables al mismo tiempo.
Según esta ecuación o ley general
Esto
significa que, si tenemos una cantidad fija de gas y sobre la misma
variamos las condiciones de presión (P), volumen (V) o temperatura (T)
el resultado de aplicar esta fórmula con diferentes valores, será una
constante.
Veamos un ejemplo, para aclarar:
Supongamos que tenemos una cierta cantidad fija de un gas (n 1 ), que está a una presión (P 1 ), ocupando un volumen (V 1 ) a una temperatura (T 1 ).
Estas variables se relacionan entre sí cumpliendo con la siguiente ecuación:
Donde R es una constante universal conocida ya que se puede determinar en forma experimental.
La misma fómula nos permite calcular el volumen molar de un gas (n) :
A modo de experimento, a la misma cantidad fija de gas (n 1 ) le cambiamos el valor a alguna de las variables tendremos entonces una nueva presión (P 2 ), un nuevo volumen (V 2 ) y una nueva temperatura (T 2 ).
Como ya conocemos le ecuación general colocamos en ella los valores de cada variable:
Según la condición inicial:
Según la condición final:
Vemos que en ambas condiciones la cantidad de gas (n 1 ) es la misma y que la constante R tampoco varía.
Entonces, despejamos n 1 R en ambas ecuaciones:
Entonces, despejamos n 1 R en ambas ecuaciones:
Marcamos con rojo n 1 R para señalar que ambos resultados deben ser iguales entre sí, por lo tanto: