lunes, 10 de septiembre de 2018
domingo, 2 de septiembre de 2018
semana 26
Reacciones químicas orgánicas:
En las reacciones orgánicas generalmente ocurren dos o mas etapas en las cuales se forman unas sustancias intermedias entre los negativos y el producto final.
Sustrato: es la sustancia que sera atacada por el reactivo y hace parte de el producto principal
Reactivo: en la Química orgánica generalmente hay 3 tipos de reactivos que son:
clasificación de reacciones orgánicas: se clasifican en polares y no polares
Polares:
No polares:

En las reacciones orgánicas generalmente ocurren dos o mas etapas en las cuales se forman unas sustancias intermedias entre los negativos y el producto final.
Sustrato: es la sustancia que sera atacada por el reactivo y hace parte de el producto principal
Reactivo: en la Química orgánica generalmente hay 3 tipos de reactivos que son:
- electrofilos
- nucleofilos
clasificación de reacciones orgánicas: se clasifican en polares y no polares
Polares:
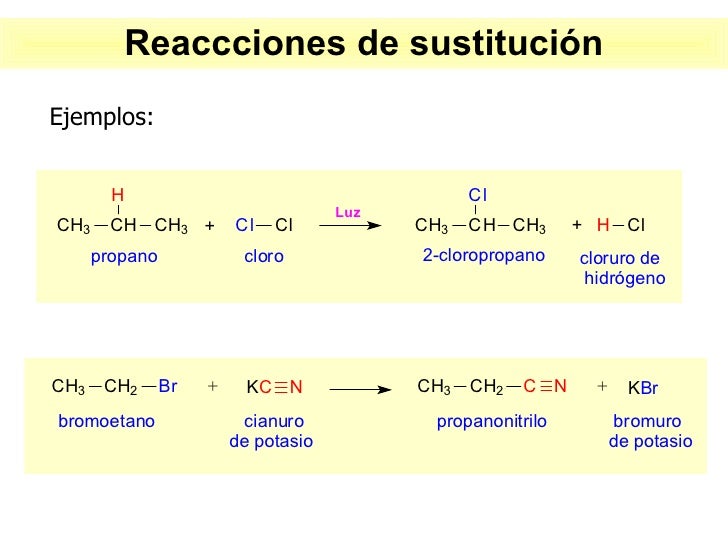
- reacciones de sustitución o desplazamiento
- reacción de adición
- reacciones de eliminación
- reacciones de reagrupacion
- reacciones de oxidación
- reacciones de ácido-base
No polares:
- reacciones de sustitución o desplazamiento
- reacciones de adición
- reacciones de eliminación
- reacciones de reagrupacion

semana 25
Reacciones orgánicas
son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones redox orgánicas. En síntesis orgánica, se usan reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La producción de muchos químicos hechos por el hombre, tales como drogas, plásticos, aditivos alimentarios, textiles, dependen de las reacciones orgánicas.
Laboratorio:
Tema: Reconocimientos de algunos grupos funcionales y propiedades fisicas de compuestos orgánicos
Logros:
son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones redox orgánicas. En síntesis orgánica, se usan reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La producción de muchos químicos hechos por el hombre, tales como drogas, plásticos, aditivos alimentarios, textiles, dependen de las reacciones orgánicas.
Laboratorio:
Tema: Reconocimientos de algunos grupos funcionales y propiedades fisicas de compuestos orgánicos
Logros:
- reconocer experimentalmente aldehídos y cetonas, accidos carboxilicos y obtener acetileno
- Reconocer las propiedades físicas de algunos compuestos orgánicos
semana 24
proyección de Fischer
Ideada por el químico alemán Hermann Emil Fischer en 1891, es una proyección bidimensional utilizada en química orgánica para representar la disposición espacial de moléculas en las que uno o más átomos de carbono están unidos a 4 sustituyentes diferentes.
Estos átomos pueden existir en dos configuraciones especialmente diferentes, que son imágenes especulares(simétricas respecto a un plano) entre sí, como lo son la mano derecha de la izquierda, y al igual que éstas no son superponibles en el espacio.
Estos átomos constituyen centros quirales o de isomería espacial. Cada centro quiral da lugar a dos moléculas isómeras especulares o enantiómeros. Una molécula con 2 centros quirales puede tener 4 estereoisómeros (22 esteroisómeros, 2 parejas de enantiómeros); una con 3 centros quirales puede tener 8 estereoisómeros (23 esteroisómeros, 4 parejas de enantiómeros); y así sucesivamente.
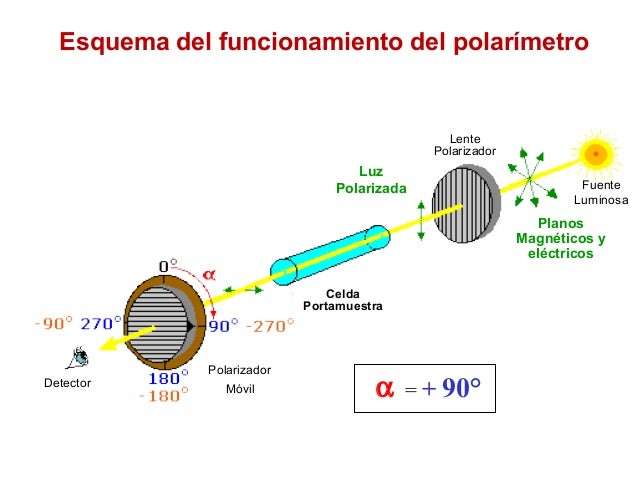
Los estereoisómeros que posibilitan los centros quirales de una molécula son, en principio, iguales química y físicamente, salvo que al incidir sobre sus respectivas disoluciones la luz polarizada el plano de vibración de ésta gira un ángulo diferente en cada caso.
En una proyección de Fischer se representa cada carbono quiral con sus cuatro sustituyentes dispuestos en cruz aplicando la siguiente convención:
- Los sustituyentes situados a derecha e izquierda sobresalen del plano de representación (papel o pantalla) y en el espacio estarían situados por delante de dicho plano, hacia el observador.
- Los sustituyentes representados arriba y debajo del centro quiral estarían situados espacial mente detrás del átomo quiral.
Hay que cuidar de no girar 90º la proyección de una molécula dada, porque obtendremos la representación de su enantiómero: los sustituyentes que en la primera estaban dirigidos "hacia el fondo" habrán pasado a estarlo "hacia adelante" y viceversa.


semana 23
La isomería cis-trans o isomería geométrica :
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono.  Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans. El isómero que tiene los hidrógenos al mismo lado se llama cis, y el que los tiene a lados opuestos trans.
Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans. El isómero que tiene los hidrógenos al mismo lado se llama cis, y el que los tiene a lados opuestos trans.
Los compuestos cíclicos, debido a su rigidez, también presentan isomería geométrica. Así, el 1,2-dimetilciclohexano puede existir en forma de dos isómeros. Se llama isómero cis el que tiene los hidrógenos al mismo lado y trans el que los tiene a lados opuestos.
- Ambos poseen la misma fórmula.
- Tienen diferentes propiedades químicas y físicas
Conformaciones del butano:

semana 22
Isomeria conformacional:

Este tipo de isómeros conformacionales o confórmeros, la conversión de una forma en otra es posible pues la rotación en torno al eje del enlace formado por los átomos de carbono es más o menos libre (ver animación a la derecha). Por eso también reciben el nombre de rotameros.
Los isómeros conformacionales generalmente no son separables o aislables, debido a la facilidad de interconversión aún a temperaturas relativamente bajas. La rama de la estereoquímica que estudia los isómeros conformacionales que sí son aislables (la mayoría son derivados del bifenilo) se llama atropisomeria.

se realizo quiz de isomeria
semana 21
Isomeria estructural:
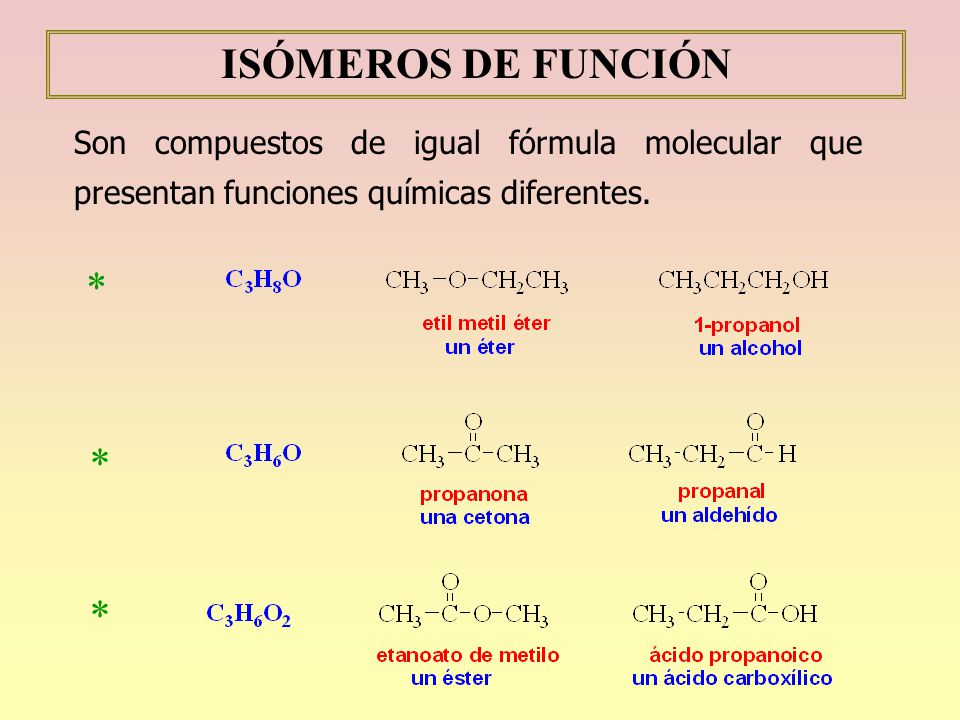
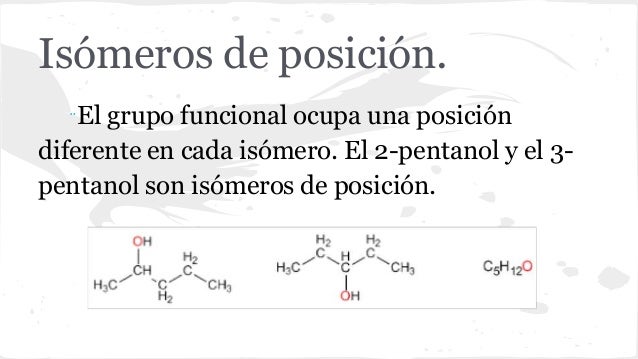
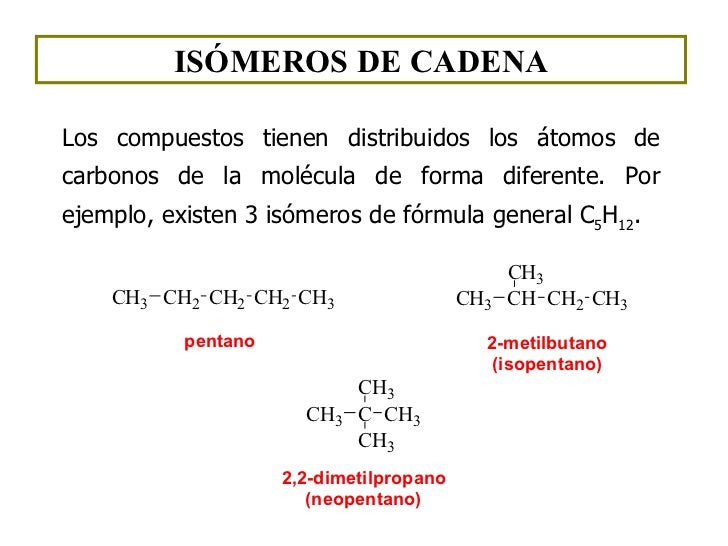
es una forma de isomeria en la que las moléculas con la misma fórmula molecular tienen diferentes patrones de unión y organización atómica, en oposición a estereoisomerismo , en el que los enlaces moleculares están siempre en el mismo orden y solo el arreglo espacial difiere. Hay sinónimos múltiples para isómeros constitucionales.
Isomeria de cadena:
Se llaman isómeros a aquellas moléculas que poseen la misma fórmula molecular pero diferente estructura. Se clasifican en isómeros estructurales y estéreo isómeros. Los isómeros estructurales difieren en la forma de unir los átomos y a su vez se clasifican en isómeros de cadena de posición y de función.



Isomeria espacial:
Presentan estéreo isomería aquellos compuestos que tienen fórmulas moleculares idénticas y sus átomos presentan la misma distribución (la misma forma de la cadena; los mismos grupos funcionales y sustituyentes; situados en la misma posición), pero su disposición en el espacio es distinta.
Los isómeros tienen igual forma en el plano. Es necesario representarlos en el espacio para visualizar las diferencias. Puede ser de dos tipos: isomería conformacional e isomería configuracional, según que los isómeros se puedan convertir uno en otro por simple rotación de enlaces simples, o no.
semana 20

ISOMERIA:
compuestos organicos
- son muy abundantes
- la mayoría poseen enlaces covalentes
- la mayoría son solubles e insolubles en h2O
- son de origen vegetal o animal
- la mayoría son combustibles
compuestos inorgánicos:
- hay muy pocos
- la mayoría poseen enlaces tónicos
- la mayoría son solubles en H2O e insolubles en orgánicos
- la mayoría no son combustibles

Suscribirse a:
Comentarios (Atom)